คลอรีน (Chlorine) ค้นพบในปี ค.ศ. 1774 โดยนักเคมีชาวสวีเดน Carl Wilhelm Scheele ซึ่งเข้าใจผิดคิดว่ามีออกซิเจนเป็นองค์ประกอบ จากนั้นได้รับการตั้งชื่อในปี ค.ศ 1810 โดย Sir Humphry Davy นักเคมีชาวอังกฤษซึ่งยืนยันว่าเป็นธาตุ (Elecment)
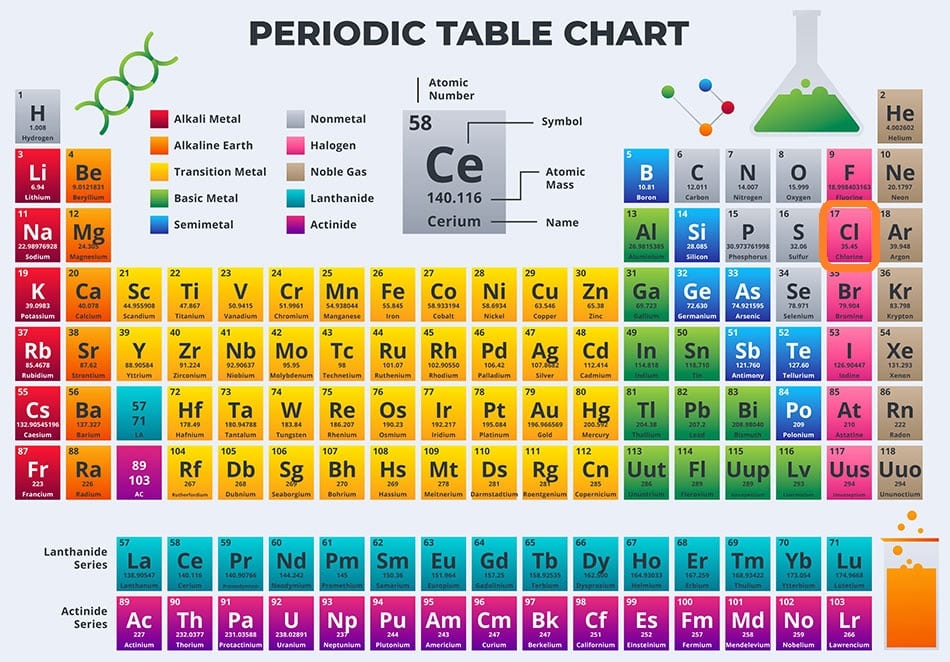
คลอรีนเป็นองค์ประกอบทางเคมีที่มีสัญลักษณ์ Cl และเลขอะตอม 17 เป็นก๊าซที่มีปฏิกิริยาสูง สีเหลืองอมเขียวที่อุณหภูมิห้องและรวมตัวกับธาตุอื่นๆ เกือบทั้งหมดได้อย่างง่ายดาย องค์ประกอบทางเคมีบริสุทธิ์มีรูปแบบของก๊าซไดอะตอม (Cl2) สีเขียว ชื่อคลอรีนมาจากคำว่า คลอโรส แปลว่าสีเขียวซึ่งหมายถึงสีของแก๊ส
หากเป็นก๊าซจะหนักกว่าอากาศสองเท่าครึ่ง มีกลิ่นที่ทำให้หายใจไม่ออกอย่างรุนแรงและเป็นพิษอย่างยิ่ง ในรูปของเหลวและของแข็งเป็นสารออกซิไดซ์ สารฟอกสี และสารฆ่าเชื้อที่ทรงพลัง

คุณสมบัติของคลอรีน
คลอรีนเป็นของเหลวภายใต้ความดัน 7.4 Bar ที่อุณหภูมิห้อง และมีสถานะที่เป็นของแข็งที่อุณหภูมิ – 150 °C แต่ที่ความดันบรรยากาศปรกติที่อุณหภูมิห้องจะมีสถานะเป็นก๊าซ (Cl2) มีสีเขียว อย่างไรก็ตามโมเลกุล Chlorine เดี่ยวๆ ไม่ปรากฏในธรรมชาติเนื่องจากมีปฏิกิริยาสูง
Chlorine ทั้งหมดที่พบบนโลกนี้อยู่ภายในสารประกอบเช่นออร์กาโนคลอรีน (Organochlorine compounds) และเกลือ (NaCl) ที่เกิดขึ้นตามธรรมชาติ เกลือในครัวทั่วไป (หรือโซเดียมคลอไรด์ NaCl) เป็นตัวอย่างที่ดีที่สุดคือเป็นส่วนประกอบของโซเดียม (Na) และคลอรีน (Cl) เมือเกลือนี้เมื่อละลายในน้ำจะให้น้ำเกลือแก่เรา ซึ่งเป็นที่ที่เราผลิตก๊าซคลอรีน (Cl2)
Chlorine เป็นธาตุฮาโลเจนเป็นอโลหะในกลุ่มที่ 17 ของตารางธาตุ คุณสมบัติของมันจึงคล้ายกับฟลูออรีน โบรมีน และไอโอดีน และส่วนใหญ่อยู่ตรงกลางระหว่างสองคุณสมบัติแรก
มีโครงสร้างอิเล็กตรอนแบบ [Ne] 3s23p5 โดยมีอิเล็กตรอนเจ็ดตัวในชั้นที่สามและชั้นนอกสุดทำหน้าที่เป็นเวเลนซ์อิเล็กตรอน 1 ตัวเช่นเดียวกับฮาโลเจนทั้งหมด
และด้วยเหตุนี้จึงเป็นตัวออกซิไดซ์ที่แรง ทำปฏิกิริยากับองค์ประกอบหลายอย่างเพื่อสร้างโครงสร้างโมเลกุลเปลือกนอกให้สมบูรณ์
ประโยชน์ของคลอรีน
1.การนำไปใช้งานอุตสาหกรรม
Chlorine เป็นสารเคมีสำคัญในการทำน้ำให้สะอาดเช่นนำไปใช้ในน้ำยาฆ่าเชื้อ ในสารฟอกขาว และในแก๊สมัสตาร์ด อีกทั้งยังใช้กันอย่างแพร่หลายในการผลิตผลิตภัณฑ์และสิ่งของต่างๆ มากมาย ทั้งทางตรงและทางอ้อมเช่นในการผลิตผลิตภัณฑ์กระดาษ น้ำยาฆ่าเชื้อ สีย้อม อาหาร ยาฆ่าแมลง สี ผลิตภัณฑ์ปิโตรเลียม พลาสติก ยา สิ่งทอ ตัวทำละลาย และสินค้าอุปโภคบริโภคอื่นๆ อีกมากมาย ดังต่อไปนี้
2.ใช้เพื่อฆ่าเชื้อแบคทีเรียและจุลินทรีย์อื่นๆ จากแหล่งน้ำดื่ม
คลอรีนมีส่วนเกี่ยวข้องกับเยื่อไม้ชายหาดสำหรับทำกระดาษ สารฟอกขาวยังใช้ในอุตสาหกรรมเพื่อกำจัดหมึกออกจากกระดาษรีไซเคิล
มักจะให้คุณสมบัติที่ต้องการหลายอย่างในสารประกอบอินทรีย์เมื่อมันถูกแทนที่ด้วยไฮโดรเจน (ยางสังเคราะห์) ดังนั้นจึงใช้กันอย่างแพร่หลายในเคมีอินทรีย์ ในการผลิตคลอเรต คลอโรฟอร์ม คาร์บอนเตตระคลอไรด์ และในการสกัดโบรมีน
3.คลอรีนในสิ่งแวดล้อม
ในธรรมชาติจะพบร่วมกับธาตุอื่นๆ โดยเฉพาะโซเดียมในรูปของเกลือทั่วไป (NaCl) เท่านั้น แต่ยังพบในคาร์นัลไลต์และซิลไวต์ด้วย คลอไรด์เป็นส่วนประกอบของเกลือส่วนใหญ่ที่ละลายในมหาสมุทรของโลก: ประมาณ 1.9 % ของมวลน้ำทะเลเป็นคลอไรด์ไอออน
ปริมาณคลอไรด์ในดินจะแปรผันตามระยะทางจากทะเล ค่าเฉลี่ยในดินชั้นบนประมาณ 10 ppm พืชมีคลอรีนในปริมาณต่างๆ เป็นธาตุอาหารรองที่จำเป็นสำหรับพืชชั้นสูงที่มีความเข้มข้นในคลอโรพลาสต์ การเจริญเติบโตจะลดลงหากปริมาณคลอไรด์ในดินลดลงต่ำกว่า 2 ppm แต่ไม่ค่อยเกิดขึ้น ขีดจำกัดสูงสุดของความอดทนจะแตกต่างกันไปตามการเพาะปลูก

สุขภาพและอันตรายจากคลอรีน
แม้ว่าจะมีประโยชน์หลายอย่าง แต่ก็อาจก่อให้เกิดความเสี่ยงต่อสุขภาพและความปลอดภัยได้หากไม่ได้รับการจัดการอย่างเหมาะสม ต่อไปนี้คืออันตรายบางประการและข้อควรระวัง
- การสัมผัสและสูดดมก๊าซ: ก๊าซคลอรีนมีความเป็นพิษสูงและอาจถึงตายได้หากมีความเข้มข้นสูง การสัมผัสกับก๊าซนี้จะทำให้เกิดปัญหาเกี่ยวกับระบบทางเดินหายใจ ระคายเคืองตา และผิวหนังไหม้ได้ หากคุณทำงานกับก๊าซชนิดนี้สิ่งสำคัญคือต้องสวมอุปกรณ์ป้องกันที่เหมาะสมเช่นหน้ากากกันก๊าซ แว่นตาและสวมชุดป้องกัน และทำงานในบริเวณที่มีอากาศถ่ายเทสะดวก
- การสัมผัสกับคลอรีนที่เป็นของเหลว: โดยทั่วไปจะใช้ในการฆ่าเชื้อในน้ำ หากสัมผัสกับผิวหนังหรือดวงตา ให้รีบล้างบริเวณที่ได้รับผลกระทบด้วยน้ำสะอาดอย่างน้อย 15 นาที แล้วไปพบแพทย์ ดังนั้นจึงเป็นเรื่องสำคัญที่ต้องใช้ในปริมาณที่เหมาะสม และในสระว่ายน้ำหรือระบบบำบัดน้ำควรตรวจสอบประมาณการใช้อย่างสม่ำเสมอเพื่อหลีกเลี่ยงการใชในปริมาณที่มากเกินไป
- การจัดเก็บและการจัดการ: ควรเก็บไว้ในที่เย็น แห้ง และมีอากาศถ่ายเทสะดวก ห่างจากแหล่งความร้อนและสารเคมีที่เข้ากันไม่ได้ เมื่อใช้งานหรือสัมผัสกับ Chlorine ให้สวมอุปกรณ์ป้องกันที่เหมาะสมและใช้ความระมัดระวังเพื่อป้องกันการหกและรั่วไหล

วิธีวัดคลอรีนในน้ำและในอากาศ
หน่วยการวัด
โดยปกติแล้วจะวัดในการผลิตน้ำดื่ม สระว่ายน้ำ การบำบัดน้ำ หรือกระบวนการทางอุตสาหกรรมและแสดงเป็นหน่วย PPM หรือ mg/L (มิลลิกรัมต่อลิตร = ppm กรณีที่ของเหลวคือน้ำ)
การวัดคลอรีนในน้ำ:
1) แถบทดสอบ: เป็นวิธีที่ง่ายและรวดเร็วในการวัดระดับคลอรีนในน้ำ เพียงจุ่มแถบลงในน้ำและเปรียบเทียบสีกับแผนภูมิเพื่อกำหนดความเข้มข้นของคลอรีน

2) ชุดทดสอบ (Test kit): วิธีนี้เกี่ยวข้องกับการเติมรีเอเจนต์ลงในน้ำที่ทำปฏิกิริยากับคลอรีนเพื่อทำให้เกิดการเปลี่ยนสี ความเข้มของสีจะถูกวัดโดยและเปรียบเทียบกับสีมาตรฐานเพื่อกำหนดความเข้มข้น

3) เครื่องวัดคลอรีน: เครื่องวัดมีหลากหลายแบรนด์ ซึ่งแต่ละแบรนด์มีวิธีการใช้งานที่แตกต่างกันไป แต่โดยทั่วโลกนิยมใช้หลักการของ DPD (N,N Diethyl-1,4 Phenylenediamine Sulfate) ซึ่งเป็นมาตรฐานที่ยอมรับทั่วโลก นิยมใช้ในโรงบำบัดน้ำเสีย การตรวจสอบน้ำดื่ม การตรวจวัดในสระวายน้ำ

หากสนใจสามารถดูรายละเอียดอุปกรณ์ตรวจวัดคลอรีนคุณภาพสูงราคาถูก
การวัดค่าคลอรีนในอากาศ:
1) เครื่องตรวจจับก๊าซแบบพกพา: เครื่องตรวจจับก๊าซแบบพกพาใช้เซ็นเซอร์เคมีไฟฟ้าเพื่อวัดความเข้มข้นของก๊าซคลอรีนในอากาศ เครื่องตรวจจับเหล่านี้มักใช้ในโรงงานอุตสาหกรรมซึ่งมีการใช้หรือผลิตก๊าซ Cl2

สนใจดูรายละเอียดเพิ่มเติมอุปกรณ์ตรวจวัดก๊าซคุณภาพสูง











